Микроцистин-LR - Microcystin-LR
 | |
| Имена | |
|---|---|
| Название ИЮПАК (5р,8S,11р,12S,15S,18S,19S,22р) -15- [3- (диаминометилиденамино) пропил] -18 - [(1E,3E,5S,6S) -6-Метокси-3,5-диметил-7-фенилгепта-1,3-диенил] -1,5,12,19-тетраметил-2-метилиден-8- (2-метилпропил) -3,6,9 , 13,16,20,25-гептаоксо-1,4,7,10,14,17,21-гептазациклопентакозан-11,22-дикарбоновая кислота | |
| Другие имена 5-L-Аргинин-микроцистин ЛА | |
| Идентификаторы | |
3D модель (JSmol ) | |
| Сокращения | MC-LR, MCYST-LR |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.150.186 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C49ЧАС74N10О12 | |
| Молярная масса | 995.189 г · моль−1 |
| Внешность | Белое твердое вещество |
| Плотность | 1,299 г / см3 |
| Растворимость в этаноле | 1 мг / мл |
| бревно п | -1.44 |
| Фармакология | |
| Проглатывание | |
| Опасности | |
| R-фразы (устарело) | R26 / 27/28, R36 / 37/38, R43 |
| S-фразы (устарело) | S26, S36 / 37/39, S45 |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 5 мг / кг |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Микроцистин-LR (MC-LR) - это токсин, вырабатываемый цианобактерии. Это самый токсичный из микроцистины.
Структура
Микроцистины циклические гептапептиды. Семь аминокислот, которые участвуют в структуре микроцистина, включают уникальную β-аминокислоту (ДОБАВИТЬ ). Это содержит аланин (D-ala), D-β-метилизоаспартат (D-β-Me-isoAsp), и глютаминовая кислота (D-glu). Кроме того, микроцистины содержат два переменных остатка, которые позволяют различать варианты микроцистинов. Эти два переменных элемента всегда стандартные L-аминокислоты. В микроцистине-LR это лейцин и аргинин.
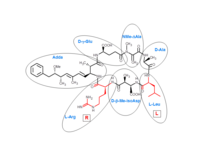
На сегодняшний день идентифицировано 80 микроцистинов, представляющих различия в двух вариабельных остатках и некоторые модификации в других аминокислотах. Эти модификации включают деметилирование Masp и Mdha и метилэстерификацию D-Glu. Различные микроцистины имеют разные профили токсичности, причем наиболее токсичным оказался микроцистин-LR.[1][2]
Биосинтез
Микроцистины маленькие нерибосомальные пептиды. В Microcystis aeruginosa микроцистин-LR синтезируется белками, которые кодируются кластером микроцистин-ген размером 55 т.п.н. (mcy), который содержит 6 больших (более 3 т.п.н.) генов, кодирующих белки с поликетидсинтаза активность, активность нерибосомальной пептидсинтазы (mcyA-E и грамм) и 4 меньших гена (mcyF и HJ). Эти большие белки состоят из разных белковые домены, придумали «модули», каждый из которых выполняет свою специфическую ферментативную функцию.[3]Хотя ферментные системы, участвующие в биосинтезе микроцистинов, не идентичны у всех цианобактерий, между ними есть большое сходство, и большинство основных ферментов законсервированы.[3][4]
Биосинтез микроцистина-LR в Microcystis aeruginosa начинается со связывания фенилацетата с mcyG фермент. В серии реакций, катализируемых разными ферментными модулями, а также разными ферментами, образуется микроцистин-LR. Полный путь биосинтеза микроцистина-LR в Microcystis aeruginosa показано на рисунке.

Первые шаги синтеза включают введение нескольких атомов углерода и кислорода между ацетил - и фенилгруппа. Эта часть синтеза катализируется доменами ферментов, которые обладают активностью β-кетоацилсинтазы, ацилтрансферазы, C-метилтрансферазы и кетоацилредуктазы. В конце этой стадии, то есть после первой конденсации глутамата, образуется аминокислота Adda.[3]Вторая часть синтеза включает конденсацию аминокислот, из которых состоит микроцистин. Таким образом, в случае микроцистина-LR последовательная конденсация аминокислот глутаминовой кислоты, метилдегидроаланина, аланина, лейцина, метиласпарагиновой кислоты и аргинина приводит к связанному продукту. Нуклеофильная атака азота в остатке Адда приводит к высвобождению циклического микроцистина-LR.[3]
Все различные микроцистины синтезируются теми же ферментами, что и микроцистин-LR.[5]
Механизм токсичности
Микроцистин-LR ингибирует протеинфосфатазы типа 1 и типа 2А (PP1 и PP2A ) активности в цитоплазме клеток печени. Это приводит к увеличению фосфорилирования белков в клетках печени. Взаимодействие микроцистина-LR с фосфатазами включает образование ковалентной связи между метиленовой группой микроцистина-LR и остатком цистина в каталитической субъединице фосфопротеинфосфатаза (PPP) семейство серин / треонин-специфичных фосфатаз, таких как PP1 и PP2A. Когда микроцистин-LR связывается непосредственно с каталитическим центром ферментов PPP, они блокировать происходит полный доступ субстрата к активному центру и ингибирование фермента. Таким образом ингибируется протеинфосфатаза и многое другое. фосфорилированный белки в клетках печени остаются, что отвечает за гепатотоксичность микроцистина-LR.
Активный центр каталитических ферментов PPP представляет собой три поверхностных бороздки: гидрофобную бороздку, кислотную бороздку и С-концевую бороздку, которые имеют Y-образную форму с активным центром в точке бифуркации. Боковая цепь Adda микроцистина-LR приспосабливается к гидрофобной бороздке, карбоксильный сайт D-Glu создает водородные связи с металлическими молекулами воды, а карбоксильная группа сайта Masp создает водородные связи с консервативными остатками аргинина и тирозина в Фермент PPP. Наконец, метиленовая группа в сайте Mdha микроцистина-LR ковалентно связывается с S-атомом остатка цистеина, а остаток лейцина плотно прилегает к другому консервативному остатку тирозина.[1]
Последствия
Микроцистин-LR токсичен как для человека, так и для животных. Есть эпидемиологические результаты исследований, которые показали симптомы отравления, связанные с наличием цианотоксинов в питьевой воде. Эффекты делятся на краткосрочные и долгосрочные.
Человеческие отравления
Нет достоверных сообщений о случаях смерти людей, которые, как известно, были конкретно вызваны микроцистином-LR, хотя есть сообщения о последствиях для здоровья после воздействия, и были случаи смерти, связанные с микроцистинами в целом.[6] Одним из самых ярких сообщений была вспышка в Каруару, Бразилия, в 1996 году. 116 пациентов испытали множественные эффекты: нарушение зрения, тошноту, рвоту и мышечную слабость. У 100 развилась острая печеночная недостаточность, а 52 страдали симптомами того, что сейчас называется «синдромом Каруару».[7] Синдром был вызван диализ терапия водой, которая не была обработана должным образом.[8]
Краткосрочные эффекты
Есть несколько краткосрочных эффектов, вызванных воздействием микроцистина-LR. Микроцистины в первую очередь гепатотоксичный соединения; Таким образом, заметные токсические эффекты проявляются не сразу. Большинство исследований токсичности проводилось на мышах, которым вводили внутрибрюшинные инъекции. Самый частый эффект - поражение печени,[9] Два из наиболее часто встречающихся симптомов: гастроэнтерит и холестатическая болезнь печени.
В эксперименте на мышах животные погибли в течение нескольких часов после введения летальной дозы микроцистина-LR. Повреждение печени можно было заметить через 20 минут. В течение нескольких часов клетки печени погибли.[10]
Долгосрочные эффекты
Острая интоксикация микроцистином-LR может привести к длительным травмам, в то время как хроническое воздействие низкого уровня может вызвать неблагоприятные последствия для здоровья. Исследования на животных доказывают, что при пероральном воздействии микроцистина-LR будет хроническое повреждение печени. Это может быть даже канцерогенный. Раки были обнаружены во время исследований на животных. Сам по себе Microcystin-LR не вызывает рака, но может стимулировать рост раковых клеток.
Эффекты животных
Microcystin-LR оказал влияние на всех животных, а не только на домашних, от купания в реке с питьевой водой с цветением цианобактерий. Симптомы при отравлении домашних животных включают диарею, рвоту, слабость, лежачее положение и в большинстве случаев приводят к летальному исходу.[11][12]
Миркоцистин-LR токсичен для всех животных, включая животных, потребляемых людьми. Рыбы и птицы также подвержены риску отравления микроцистином LR.
Пути воздействия
Цианобактерии предпочитают жить в водоемах, таких как озера, пруды, водоемы и тихоходные ручьи. Когда вода теплая, бактерии могут выжить в достаточном количестве питательных веществ. Большинство цианобактерий продуцируют токсины, из которых микроцистин - только одна группа. Когда цианобактерия умирает, ее клеточная стенка разрушается, а токсины высвобождаются в воду. Микроцистины чрезвычайно стабильны в воде и выдерживают химическое разложение, такое как гидролиз или окисление. В период полураспада этого токсина составляет 3 недели при pH 1 и 40 ° C. Однако при обычных условиях окружающей среды период полураспада составляет 10 недель.[9]
После попадания в воду микроцистины активно всасываются рыбами и птицами из отравленной воды и таким образом попадают в организм. пищевая цепочка. Люди также подвергаются воздействию микроцистинов при выполнении действий в отравленной воде.[13]
Диспозиция и обмен веществ
Диспозиция
Микроцистин-LR быстро выводится из плазмы крови. Периоды полужизни в плазме для α- и β-стадий, соответствующие распределению и элиминации, составляют соответственно 0,8 и 6,9 минут.[14][15] Общий клиренс соединения из плазмы составляет около 0,9 мл / мин. Выведение соединения в основном происходит с калом и мочой. Через 6 дней примерно 24% принятой дозы выводится из организма, из которых около 9% выводится с калом и 14,5% - с мочой.[15]
Микроцистин-LR в основном концентрируется в печени. Другие ткани подвергаются гораздо меньшему воздействию.[15]
Метаболизм
Данных о метаболизме микроцистина-LR у человека очень мало. Данные о метаболизме и распределении токсина у мышей и крыс более доступны. У этих животных микроцистин-LR быстро концентрируется в печени.[16] Интоксикация мышей микроцистином-LR приводила к снижению уровня цитохром P450 и цитохром b5 и увеличение цитохрома P420, в который конвертируется CYP450. Наряду с тем фактом, что мыши с индуцированной более высокой концентрацией CYP450 менее подвержены воздействию токсина, это позволяет предположить, что CYP450 играет важную роль в детоксикации соединения.
На этапе 2 биотрансформации соединение конъюгируется с несколькими различными эндогенными веществами. Микроцистин-LR, как известно, выводится в виде конъюгата глутатиона, конъюгата цистеина и окисленного диенового конъюгата ADDA. Глутатион и цистеин конъюгированы с фрагментом Mda. Окисленный ADDA конъюгирован на сопряженная связь.[17]
Токсичность
Токсичность цианотоксины очень разнообразен и включает нейротоксичность, гепатотоксичность, цитотоксичность и дерматотоксичность. Микроцистины обычно связаны с гепатотоксичностью. Токсическое действие микроцистинов связано с ингибированием ими протеинфосфатаз.[18]
Острая подострая токсичность
Многие исследования проводились с внутрибрюшинное введение. Из-за различий в липофильности и полярности разных микроцистинов нельзя предположить, что i.p. LD50 предсказывает токсичность после перорального приема.[9]
Микроцистины - это гепатотоксины. После острого воздействия заметны тяжелые поражения печени по нарушению клеточной структуры печени. Вес печени увеличится за счет внутрипеченочного кровоизлияние, гемодинамический шок, сердечная недостаточность и смерть.[9]
После назального введения микроцистина-LR эпителий носовой слизистая оболочка как обонятельной, так и респираторной зон страдали некрозом. После перорального приема были замечены даже поражения печени. LD50 для назального введения равна внутрибрюшинному введению.
Повторное пероральное введение
Для оценки возможных хронических последствий для здоровья человека наиболее желательны исследования, включающие многократное пероральное введение чистых микроцистинов в различных дозах. В исследовании на мышах чистый мироцистин-LR вводили перорально в дозах 0, 40, 200 или 1000 мкг / кг веса тела. При самой высокой дозе почти у всех мышей наблюдались изменения печени, хроническое воспаление и некоторые другие симптомы. У самок мышей при максимальной дозе наблюдались только изменения трансаминаз.[9]
Канцерогенность
Только микроцистин
У мышей наблюдались неопластические узелки в печени после 100 пероральных введений в дозе 20 мкг / кг массы тела. Наблюдаемые узелки достигали 5 мм в диаметре. Однако ни у одной мыши не было обнаружено узелков в печени после 100 введений 80 мкг / кг.
Взаимодействие с опухолями
Комитет IARC пришел к выводу, что микроцистин-LR, возможно, канцерогенен для человека. Итак, сам микроцистин-LR не является канцерогеном, но он стимулирует рост опухоли. У мышей, получавших канцерогенное соединение диметилбензатрацен, наблюдалось увеличение количества и веса кожных опухолей.[6]
В естественных условиях эксперименты на животных
Об острой токсичности для человека известно очень мало, но были проведены исследования на животных, которые показали следующие результаты.
| Способ применения [19] | Токсичность | Разновидность | Ценить |
|---|---|---|---|
| Устный | LD50 | Мышь | 5 мг / кг |
| Ингаляция, 10ч | LC50 | Мышь | 18 мг / кг |
| Интраперитонеальный | LD50 | Крыса | 0,05 мг / кг |
| Интраперитонеальный | LD50 | Мышь | 0,0325 мг / кг |
| Внутривенно | LD50 | Мышь | 0,06 мг / кг |
Когда вводятся микроцистины внутривенно или же внутрибрюшинно, они локализуются в печени. Это, по-видимому, результат поглощения гепатоциты. В докладе ВОЗ говорится, что микроцистины смертельны для мышей при внутрибрюшинном воздействии от 25 до 150 мкг / кг массы тела.[9] Возможно, из-за плохой абсорбции после воздействия пероральные микроцитины менее токсичны, поскольку летальная доза для мышей составляет от 5 до 10 мкг / кг массы тела. Гепатотоксичность в виде некроза печени возникает в течение 60 минут после внутривенного введения.[18]Цветение Microcystis aeruginosa не вызвали увеличения частоты опухолей в группах мышей, получавших лечение до одного года. Показано, что у мышей, которым вводили 20 мкг / кг массы тела 4 раза в неделю в течение 28 недель, развивались новообразования печени.[18] Однако результаты неоднозначны. При пероральном введении микроцистин-LR проявляет острую токсичность для грызунов. Очевидно, что значительное количество пероральной дозы преодолевает кишечный барьер.
Эффекты развития
Микроцистины не проявляют токсичности для развития.
Генотоксичность
ВОЗ заявляет, что микроцистин-LR не обладает мутагенным действием. Однако индукция разрывов цепи ДНК в лимфоцитах наблюдалась у мышей после однократного перорального введения. Эффект зависит от времени и дозы. Нет изменений в экспрессии выбранных генов, участвующих в клеточном ответе на повреждение ДНК после 4-часового воздействия. Через 24 часа гены, чувствительные к повреждению ДНК, были активированы, что указывает на то, что микроцистин-LR является косвенным генотоксическим агентом.[20] В Китае самый высокий уровень заболеваемости раком печени наблюдается в районах с многочисленными цианобактериями в поверхностных водах. Развитие опухоли связано с воздействием низкой концентрации в течение длительного периода времени.[18]
В пробирке исследования
В пробирке исследования показали, что микроцистин-LR является мощным ингибитором протеинфосфатаза 1 (ПП-1) и PP2A, но не влияет на протеинкиназа C или же циклическая АМФ-зависимая киназа. Мутагенность не проявляется для очищенных токсинов, полученных из Микроцистис, хотя токсины были кластогенный для лимфоцитов человека.[18]
Биоразложение
А металлопротеиназа фермент, выделенный из бактерий на Озеро Роторуа, среди прочего, называется микроцистиназа, является частью пути биодеградации 3 ферментов. Этот конкретный фермент приводит к продукту, токсичность которого снижается в 160 раз.[21]
История
Китайский генерал Чжу-Гэ Лян был первым, кто наблюдал отравление цианобактериями около 1000 лет назад. Он сообщил о гибели пьяных солдат. вода зеленого цвета из реки на юге Китая.[нужна цитата ] Первое опубликованное сообщение о случаях отравления цианобактериями датируется отравлением австралийского озера в 1878 году.[22] Также в Китае и Бразилии люди умирали, выпив воду из озера. Все эти инциденты были приписаны цианобактериям и токсичному соединению микроцистин-LR. Вот почему Всемирная организация здоровья (ВОЗ) выпустила руководство по микроцистинам в питьевой воде. Рекомендации ВОЗ по содержанию микроцистинов в питьевой воде на основе микроцистина-LR составляют 1 мкг / л.[14] С высоким уровнем Эвтрофикация в Южной Африке типичное воздействие может достигать 10 мкг / л.[23][24][25][26]
Рекомендации
- ^ а б С. Перейра, В. Васконселос и А. Антунес, Компьютерное исследование ковалентного связывания микроцистинов с остатками цистеина - реакции, участвующей в ингибировании семейства протеинфосфатаз PPP, Журнал FEBS, DOI: 10.1111 / j.1742-4658.2011.08454.x
- ^ А. Кампос и В. Васконселос, Молекулярные механизмы токсичности микроцистина в клетках животных, Int. J. Mol. Sc., 11 (1), с. 268-287.
- ^ а б c d D. Tillett et al., Структурная организация биосинтеза микроцистина у Microcystis aeruginosa PCC7806: интегрированная система пептид-поликетидсинтетаза, Chem. Биол., 7 (10), стр. 753-764.
- ^ Г. Кристиансен и др., Биосинтез микроцистина в планктотриксе: гены, эволюция и манипуляции, J. Bacteriol., 185 (2), стр. 564-572.
- ^ Т. Нисидзава и др., Ген поликетид-синтазы, связанный с модулем пептид-синтетазы, участвующий в биосинтезе циклического гептапептидного микроцистина, J. Biochem., 127 (5), стр. 779-789.
- ^ а б Бултер, Н., Карлайл, Дж. Микроцистины: краткий обзор их токсичности и воздействия с особым акцентом на рыбу, диких животных и домашний скот. Департамент водных ресурсов, Калифорния. Январь 2009 г.
- ^ Азеведо, С. и другие., Интоксикация человека микроцистинами во время лечения диализом почек в Каруару, Бразилия. Токсикология, 2002. 181-182: п. 441-6.
- ^ Jochimsen, E.M. et al., Печеночная недостаточность и смерть после воздействия микроцистинов в центре гемодиализа в Бразилии. N Engl J Med, 1998. 338(13): с. 873-8.
- ^ а б c d е ж ВОЗ (2003 г.) Цианобактериальные токсины: Microcystin-LR в питьевой воде. Справочный документ для подготовки Руководства ВОЗ по качеству питьевой воды. Женева, Всемирная организация здравоохранения WHO / SDE / WSH / 03.04 / 57).
- ^ Слаткин Д.Н. и др. Атипичный тромбоз легких, вызванный токсическим цианобактериальным пептидом. Наука, 1983. 220(4604): с. 1383-5.
- ^ DeVries, S.E., et al., Клинические и патологические данные интоксикации сине-зелеными водорослями (Microcystis aeruginosa) у собак. "" Журнал ветеринарных диагностических исследований, 1993. "" 5 "(3): стр. 403.
- ^ Briand, J.F., et al., Опасность для здоровья наземных позвоночных, вызываемая токсичными цианобактериями в экосистемах поверхностных вод. ”Vet Res, 2003.‘ ’’ 34 ’’ ’(4): p. 361-77.
- ^ Харада, К.И. и др., Устойчивость микроцистинов цианобактерий. III. Влияние pH и температуры Phycologia, 1996. 35 (6) с. 83-88.
- ^ а б Хор, И., и Дж. Бартрам, Токсичные цианобактерии в воде; Руководство по их последствиям для общественного здоровья, мониторингу и управлению. Лондон: E & FN Spon, 1999.
- ^ а б c Робинсон, Н.А., Пейс, Дж. Г., Матсон, К. Ф., Миура, Г. А. и Лоуренс, У. 1991 г. Распределение в тканях, экскреция и биотрансформация в печени микроцистина-LR у мышей, J.Pharmacol. Exp. Ther., 256 (1), 176-182.
- ^ Брукс, В. и Кодд, Г.А. 1987 г. Распределение пептидного токсина Microcystis aeruginosa и взаимодействие с микросомами печени у мышей Pharmacol. Toxicol., 60 (3), 187-191.
- ^ Кондо, Ф., Мацумото, Х., Ямада, С., Исикава, Н., Ито, Э., Нагата, С., Уэно, Й., Судзуки, М. и Харада, К.-И. 1996 г. Обнаружение и идентификация метаболитовобразованные микроцистины in vivo в печени мыши и крысы Chem. Res. Toxicol., 9 (8), 1355-1359.
- ^ а б c d е Отчет Национальной токсикологической программы о токсичности микроцистина, https://ntp.niehs.nih.gov/ntp/htdocs/chem_background/exsumpdf/microcystin_508.pdf (по состоянию на 1 марта 2012 г.)
- ^ Информация о продукте Sigma Aldrich, http://www.sigmaaldrich.com/catalog/product/sigma/m2912 (по состоянию на 1 марта 2012 г.)
- ^ Зегура. B, et al. «Микроцистин-LR вызвал повреждение ДНК в лимфоцитах перифальной крови человека». Исследование мутаций 725 (2011). ‘’ ’116-122’ ’’
- ^ Сомди, Тирасак; Громы, Мишель; Рак, Джон; Лис, Изабель; Эллисон, Маргарет; Пейдж, Рэйчел (2013). «Разложение [Dha7] MC-LR бактерией, разрушающей микроцистин, выделенной из озера Ротоити, Новая Зеландия». ISRN Микробиология. 2013: 1–8. Дои:10.1155/2013/596429. ЧВК 3712209. PMID 23936728.
- ^ Фрэнсис, Г. Ядовитое австралийское озеро Природа 18, 11-12 (1878)
- ^ Оберхолстер П.Дж., Клоэте Т.Э., ван Гинкель К., Бота А.М. И Эштон, П.Дж. 2008. Использование дистанционного зондирования и молекулярных маркеров в качестве индикаторов раннего предупреждения о развитии цианобактериальной корки гиперкасса и генотипов, продуцирующих микроцистин, в гипертрофическом озере Хартебиспорт, Южная Африка. Претория: Совет по научным и промышленным исследованиям (CSIR).
- ^ Тертон, А. 2015. Загрязнение воды и беднота Южной Африки. Йоханнесбург: Южноафриканский институт расовых отношений. http://irr.org.za/reports-and-publications/occasional-reports/files/water-pollution-and-south-africas-poor В архиве 2017-03-12 в Wayback Machine
- ^ Тертон, А. 2016. Южная Африка и засуха, обнажившая молодую демократию. В водной политике (18); 210 - 227. http://wp.iwaponline.com/content/ppiwawaterpol/18/S2/210.full.pdf
- ^ Мэтьюз М.В. и Барнард С. 2015. Эвтрофикация и цианобактерии в стоячих водоемах Южной Африки: взгляд из космоса. В Южноафриканском научном журнале. Vol. 111. № 5/6.
